물리화학, 그 첫 번째 이야기 | 열역학 제 1법칙
이번 포스팅에서는 열역학 법칙, 그 중에서도 열역학 제 1법칙에 대해서 다룰 것이다.
우선, 열역학 법칙은 크게 총 3가지가 있는데, 0법칙, 1법칙 그리고 2법칙이 있다. 먼저 열역학 제 0법칙에 대해서 알아보자.
| 열역학 제 0법칙 계(system) A, B, C에 대해 A와 B가 열적 평형 상태에 있고 B와 C가 열적 평형 상태에 있으면 A와 C도 열적 평형 상태에 있다. |
열역학 제 0법칙은 간단하게 다음 그림으로 설명 가능하다.
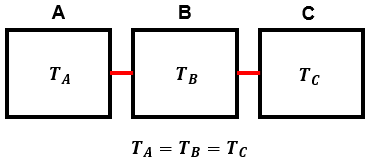
열역학 제 0법칙은 열적 평형 뿐만 아니라, 열의 이동에 대해서도 이야기할 수 있으며, 동시에 그 척도가 온도라는 것을 말해주는 열역학의 기본이 되는 법칙이다. 다음은 열역학 제 1법칙이다.
| 열역학 제 1법칙 고립계의 에너지 총량은 일정하다. |
열역학 제 1법칙을 수식으로 나타내면 다음과 같다: $ \Delta U = q + w $. 여기서 ΔU는 내부 에너지라는 물리량으로, 물질이 가지고 있는 총 에너지를 말한다. q와 w는 각각 열과 일이다.
우선, 내부 에너지에 대해서 더 자세히 알아보기 전에, 열과 일이 무엇인지부터 알아야 한다. 우선 일이란, 물리에서도 다루지만 힘을 가해서 물체를 움직이는 것으로, 열역학에서는 에너지, 특히 운동에너지의 형태로 전달되는 에너지의 양을 의미한다. 열역학에서 특히 자세하게 다루는 것은 팽창 일로, 기체가 외부 압력에 대항하여 팽창할 때 한 일의 양이며 다음과 같은 수식으로 나타낼 수 있다.
| 팽창 일 기체가 외부 압력 $P_{ext}$에 대항하여 $ \Delta V $만큼 팽창했을 때, $ w = -P_{ext} \Delta V $. |
음의 부호(-)는 부피가 늘어났을 때 기체가 외부에 일을 해주었기 때문에 내부의 에너지가 감소해서 붙은 것이라고 생각하면 된다. (화학은 계의 외부가 아닌 내부를 중심으로 다루기 때문에, 물리학에서의 일과 부호가 반대가 된다.)
다음으로 열이란, 역학적 상호작용 없이 계의 내부 에너지를 증가시키는 수단을 말한다. 즉, 운동 에너지의 형태가 아닌 다른 형태로 전달되는 에너지를 열이라고 할 수 있다. 열과 밀접한 관련이 있는 수치가 온도인데, 열용량, 비열, 몰 열용량 등을 이용하여 열의 양을 온도와 연관지을 수 있다.
위에서 소개한 일과 열은 모두 경로 함수이다. 경로 함수란, 변화량이 경로에 의존하는 함수(물리량)을 말하며, 경로에 상관없이 처음과 마지막 상태만 같으면 변화량이 같은 함수(물리량)인 상태 함수와 대비되는 개념이다. 일과 열은 모두 경로 함수이지만, 둘의 합으로 나타내어지는 내부 에너지는 상태 함수로, 초기 상태와 최종 상태만 같으면 경로에 상관없이 그 변화량이 같다. (내부 에너지가 상태함수인 것은 귀납적인 결과로, 받아들이고 넘어가자.)
다음 포스팅에서는 열화학에서 중요한 물리량인 엔탈피에 대해서 다룰 것이다.
'화학 > 물리화학 | Physical Chemistry' 카테고리의 다른 글
| 물리화학, 그 세 번째 이야기 | 이상 기체의 열역학적 특성 (0) | 2022.01.08 |
|---|---|
| 물리화학, 그 두 번째 이야기 | 엔탈피 (0) | 2022.01.08 |
| 물리화학, 서론 | 기체 - 보일 온도, 평균 자유 행로 (0) | 2020.05.14 |